作者: 时间:2023-08-17
Wang H等在其文章中提出了一种关于促红细胞生成素(EPO)检测的方法,EPO是一种重要的糖蛋白激素。重组人EPO(rhEPO)是一种重要的治疗药物,也可作为体育运动中的兴奋剂。制药和体育领域EPO gly-co构体的分析从几个方面给分析科学家带来了很大的挑战,其中灵敏的检测和有效便捷的样品制备是两个关键问题。在此,我们探讨了这两个方面的新可能性。建立了深紫外激光诱导荧光检测(Deep UV-LIF)来检测EPO的本征荧光,并建立了免疫磁珠提取(IMBE)来特异性提取EPO糖型。结合毛细管区带电泳(CZE), 深紫外激光诱导荧光检测(crylas紫外光源)允许高分辨率糖型分析,提高灵敏度。与UV吸光度法相比,检测灵敏度提高了一个数量级。另一个优点是,由于不需要荧光标记,可以完全保留原始的糖型分布。将IMBE与CZE-deep UV-LF相结合,总检测灵敏度为1.5×10-8 mol/L,相对于传统CZE UV吸光度检测提高了2个数量级。适用于EPO制剂的分析但对血液和尿液中EPO的反兴奋剂分析灵敏度不足。IMBE是一种简单有效的样品制备方法。然而,具有高特异性的抗体是应用于尿液样本的关键,因为一些尿蛋白会严重干扰免疫提取。
促红细胞生成素(EPO)是一种主要由肾脏产生的糖蛋白激素,它刺激红细胞的产生。重组人促红细胞生成素(recombinant humanerythropoietin,rhEPO)自1989年上市以来,因其在临床上用于治疗贫血而成为具有较高经济价值的蛋白之一。此外,rhEPO还可以作为兴奋剂,帮助运动员在耐力运动中提高成绩。由于误用rhEPO可能导致红细胞增多症,国际奥委会(IOC)自1990年起禁止在体育运动中使用rhEPO。对EPO的分析,特别是对体育运动中的EPO的分析,给分析科学家带来了一系列巨大的挑战。EPO存在于数百种同分异构体中,其聚糖结构差异很小,而不同的糖异构体具有不同的生物活性。这些糖型的高分辨率分离是生物制药工业质量控制的关键,也是在反兴奋剂分析中区分天然和重组EPO的重要标志。此外,人类的EPO是健康人的血液(10-11-10-12 M)和尿液(10-13-10-14 M)中epo的浓度非常有限,超高灵敏度检测是运动中可靠检测的关键之一。由于EPO在高浓度下不稳定,灵敏的检测也是药物分析的重要资产。此外,样品基质具有戏剧性的作用。即使是商业化的rhEPO药物和标准品,由于其含有大量赋形剂,基质效应也相当明显。样品前处理是运动和生物制药领域EPO检测的关键。
Lasne等人已经很好地建立了运动中的EPO测定方法。根据凝胶等电聚焦(gel IEF)的糖型分析,rhEPO与天然类似物有所区别。使用超滤对尿样进行清理和富集,同时使用化学发光检测(CL)提供足够的灵敏度。虽然已被IOC正式批准,但该方法存在明显的缺点:劳动密集、耗时和成本低。Khan等人提出了一种二维凝胶电泳(2DGE)方法,用于将rhEPO与其尿液中的内源性类似物区分开来。与官方方法一样,该方法也存在类似的缺陷。因此,进一步努力克服这些缺点是非常必要的。
作者团队在这项研究中的目标是瞄准灵敏检测和有效样品制备的新可能性,建立一套深紫外激光诱导荧光检测系统来检测EPO的天然荧光,基于免疫磁珠的提取方法IMBE,对EPO进行快速免疫亲和纯化富集,然后进行CZE-deep UV-LIF分析。深紫外诱导荧光系统所用仪器设备如下:
所有CE分离均在配备双通道激光诱导荧光检测器的P/ACE MDQ系统(Beckman Coulter, Fullerton, CA, USA)上进行。根据Britz-McKibbin及其同事的描述,稍加修改,建立了以crylas为检测光源的实验室内置的深紫外激光诱导荧光检测系统。采用266nm二极管泵浦固态调Q Nd:YAG激光器 ( CryLaS GmbH, Berlin, Germany ) 作为激发光源,用紫外多模光纤跳线(Oz Optics, Carp, Ontario, Canada)耦合到CE仪器。使用窄带通(全宽最大一半,25 nm)发射滤光片(Andover Corporation, Salem, USA)在340 nm处进行天然荧光检测。分离柱采用50 μm i.d. × 60 cm (有效长度为50 cm)的裸熔融石英毛细管(中国河北永年光纤厂)。每天毛细管先用0.1 M NaOH预处理60分钟,然后用运行缓冲液预处理60分钟。在运行预处理之间,用0.1 M NaOH浸泡5 min,再用流动缓冲液浸泡10 min。所有溶液均通过孔径为0.45 μm的亲水性膜过滤器过滤。毛细管在35℃恒温。样品以3.45 kPa的压力注入15s。分离电压为15kV。
两条通过免疫磁珠的路线被用来提取EPO,如图所示,路线1将抗EPO抗体定向固定在蛋白质上A磁珠上,然后将抗EPO抗体固定化蛋白磁珠与含EPO的样品一起孵育;最后,用适当的净化溶液洗去非特异性吸附物质之后,用适当的缓冲液从蛋白质A磁珠中冲洗掉抗EPO抗体和EPO。路线2是先将抗EPO抗体与含EPO的样品孵育,形成免疫复合物,复合物结合到蛋白质上通过抗EPO抗体的Fc区与蛋白A之间的相互作用形成磁珠,最后,在用适当的净化溶液洗去非特异性吸附物质之后,用适当的洗脱缓冲液从蛋白A磁珠中洗脱抗EPO抗体和EPO。两条路线的反应、取和洗脱均在200uL塑料微离心管中进行,并在旋转器上搅拌。两条路线中的所有步骤都可以通过磁珠的磁操纵来容易地处理。洗脱液注入CZE-deep UV-LIF分析。
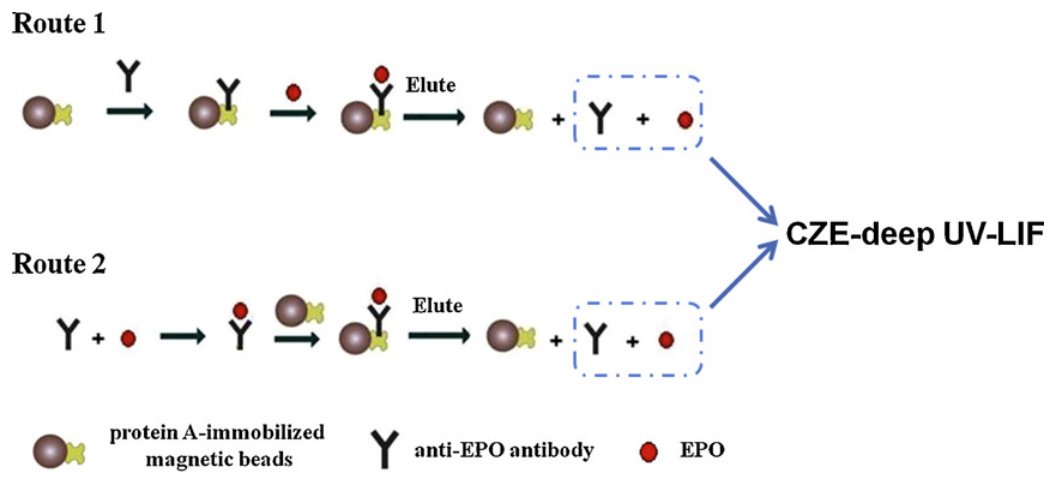
尿液样本取自两名健康志愿者。尿液样本被冷冻在零下20摄氏度。室温解冻,向20mL尿中加入2mL375M Tris/HCI、pH7.4和0.5mL完全蛋白酶抑制剂混合液。样品在82-85C热水浴中加热10min,然后立即在冷水中冷却约10min。在2700×g和20℃离心20min后,用孔径为0.22μm的亲水膜过滤器过滤上清,然后加入适量的BRP标准制剂。EPO加药量的尿标本,再送至15mL阿米康Ultra-15(MWCO10,000Da),然后在5000×g和20℃离心30 min。 然后在相同的条件下用20mL 50 mM Tris/HCI、pH7.4和0.5mL全蛋白酶抑制剂混合液清洗,在相同的Amicon ultra-15进行离心,洗涤后的滞留液(约100pL) 按照生产商的指示回收,并转移到Amicon Ultra-0.5(MWCO50000Da) 中以除去尿液中与抗EPO抗体交叉反应的蛋白质。收集滤液。最后,在加标尿液样本中的EPO被蛋白质A磁珠富集。
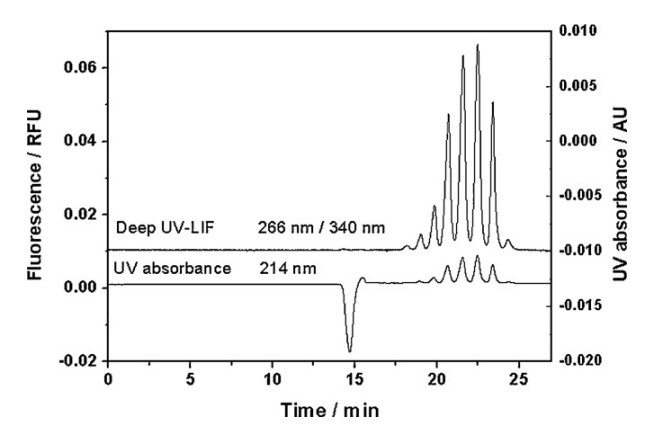
深紫外激光诱导荧光检测利用了固有的荧光分析物如色氨酸、酪氨酸和苯丙氨酸对消除衍生化的需要,内源性EPO具有3个色氨酸、4个酪氨酸和4个苯丙氨酸残基而外部我们的EPO有5个色氨酸,4个酪氨酸和4个苯丙氨酸残基。因此,深紫外激光诱导荧光检测技术非常适合于EPO的检测。首次研究了深紫外激光诱导荧光检测器的性能,并与配备MDQ仪器的紫外吸收检测器进行了比较。如图所示,在相同条件下,深紫外激光诱导荧光检测提高了检测灵敏度,峰面积和峰高比紫外吸光度提高了1个数量级。由于检测灵敏度的提高,深紫外激光诱导荧光检测可观察到更多的峰,深紫外激光诱导荧光检测可检测到8个峰,而紫外吸光度检测仅观察到7个峰。 虽然与荧光染料标记相比,天然荧光的灵敏度提高并不明显,但天然荧光标记的优点在于:荧光检测是蛋白质的糖型轮廓被完全保存(见图),这是区分内源性和外源性EPO的关键。与荧光标记的激光诱导荧光检测不同,深紫外激光诱导荧光检测不仅避免了繁琐的标记过程,甚至涉及有毒化学物质,而且避免了也扭曲的糖分布,由于在属性的变化所造成的标记。
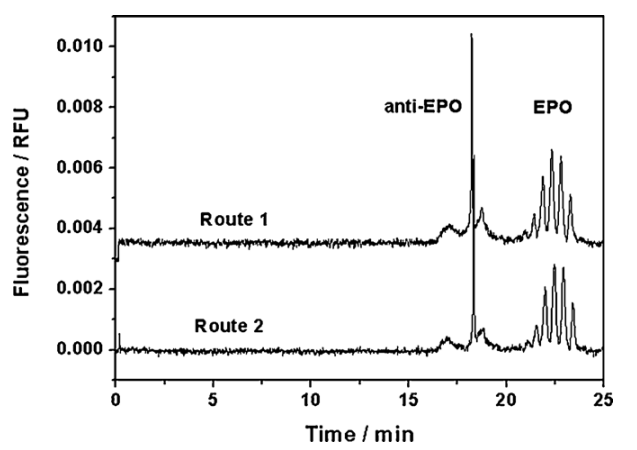
我们建立了一个深紫外激光诱导荧光检测灵敏检测的EPO和一种方便提取的免疫提取方法EPO。并与传统的紫外吸收度检测方法进行了比较。检测灵敏度提高了1个数量级。与常规的荧光标记的激光诱导荧光检测不同,深紫外激光诱导荧光检测可以保留原始的糖基分布,从而区分内源性和重组EPO。以磁珠为提取探针,IMBE法可有效提取药物中的EPO但本研究中所用的抗体与其他尿蛋白有交叉反应,不适合尿液样品的提取。 将两组分法与CZE分离相结合,与常规CZE法相比,紫外吸收法检测灵敏度提高了2个数量级。因为速度,分辨率和灵敏度。IMBE-CZE-深紫外-LIF法可作为制药行业质量控制的有效工具。
参考文献
[1] Wang H , Dou P ,Chenchen Lü,et al.Immuno-magnetic beads-based extraction-capillary zone electrophoresis-deep UV laser-induced fluorescence analysis of erythropoietin[J].Journal of Chromatography A, 2012, 1246(none):48-54.DOI:10.1016/j.chroma.2012.02.017.